(2014江苏高考)
2023-10-28 01:52:45 作者:小米儿Sunny 文章来源:66软件下载 阅读次数:291
[答案](1) 2H2O+2e-

H2↑+2OH- (或2H+ + 2e- = H2↑)
(2) 2H2
S

2H2
+ S2
(3)加快铁与稀硫酸反应速率 使铁粉充分反应 抑制 Fe2+的水解。
[解析](1) 阴极是阳离子放电,钠离子和氢离子竞争,最终是氢离子放电生成氢气;
(2)根据图示可知,分解达到平衡过程中,一种产物的体积分数由5%变化到20%,变化量为15%,另一种产物由10%转化为40%,变化量为30%,故一种产物的物质的量是另一种产物的2倍,再结合原子守恒,可知另一种产物为S2 。
(3)铁屑与稀硫酸反应中,加入稍过量的稀硫酸,一方面是保证铁屑充分反应,另一方面过量的稀硫酸可以抑制硫酸亚铁的水解。
[考题分析]
| 年份 | 知识点 | 分值 |
| 2010 | 热化学方程式书写 | 2 |
| 平衡原理应用 | 4 | |
| 电解池产物判断 | 2 | |
| 2011 | 热化学方程式书写 | 2 |
| 平衡常数表达式书写 | 2 | |
| 原电池方程式书写 | 2 | |
| 2012 | 反应热计算 | 2 |
| 平衡常数表达式书写 | 2 | |
| 原电池方程式书写 | 2 | |
| 2013 | 反应热计算 | 2 |
| 2014 | 电解池电极反应式书写 | 2 |
| 平衡计算 | 2 |
[备考策略]
近几年高考这部分内容的热门考点有:
1.原电池、电解池电极反应式或者化学方程式的书写;
2.热化学方程式书写或者反应热的计算;
3.平衡原理的应用;
4.平衡常数表达式的书写
我们在复习中还需要关注的考点有:
1.化学反应速率的计算以及影响因素分析;
2.化学平衡状态的特征
3.浓度、温度、压强等对化学平衡的影响;
4.平衡常数的计算及其运用;
5.平衡图像的分析
[高考前沿]
1.(2014常州一模)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)

2I2O5(s) ΔH=-75.56 kJ·mol-1
2CO(g)+O2(g)

2CO2(g) ΔH=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2) 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)
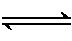
N2(g)+2CO2(g) ΔH<0
①该反应的化学平衡常数表达式为K= 。
②一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. N2和CO2的体积比保持不变
d. 每生成1 mol N2的同时生成2 mol NO
③若在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如下图所示。若保持温度不变,20 min时再向容器中充入CO、N2各0.6 mol,平衡将 (填“向左”、“向右”或“不”)移动。20 min时,若改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能是 (填字母)。
a. 加入催化剂 b. 降低温度 c. 增加CO2的量
(3) 电化学降解NO3-的原理如下图所示。电源正极为 (填“A”或“B”)极,阴极反应式为 。
[答案]
(1) 5CO(g)+I2O5(s)

5CO2(g)+I2(s) ΔH=-1377.22 kJ·mol-1
(2) ①c(N2)c(CO2)2/[c(CO)2c(NO)2 ] ②ad ③不 b
(3) ①A 2NO3-+12H++10e-

N2↑+6H2O
[解析] (1) 将第二个热化学方程式×5减去第一个热化学方程式后再除以2,即得到目标热化学方程式为 5CO(g)+I2O5(s)

5CO2(g)+I2(s) ΔH=-1377.22 kJ·mol-1。
(2)②由于反应前后气体体积不相等,故压强不变时反应达平衡状态,a能说明;混合体系中的四种气体都是无色,故颜色不变不能作为判断达到平衡状态的标志,b不能说明;若平衡是从反应物端建立,无论是否达到平衡,体系中的N2和CO2体积比恒为1∶2,c不能说明;根据化学方程式可知,每生成1mol N2的同时消耗2mol NO,反应达平衡状态,d能说明。③由表中数据可知该反应的平衡常数K==0.035,当再充入CO、N2各0.6mol时Qc===K,故平衡不移动;由图示可看出,改变条件后N2浓度增大,而加入催化剂只能加快反应速率而不能使平衡移动,N2浓度不变;该反应的正反应为放热反应,故降低温度可使平衡正向移动,N2增大;增加CO2的量,使平衡逆向移动,N2浓度减小,故改变的条件只能是降低温度。(3) 根据右侧电池中NO3-→N2可知,该过程中N元素化合价降低,得电子,是电解池的阴极,电极反应式为2NO3-+12H++10e-

N2+6H2O;B电极为电源的负极,A电极为电源的正极。
2.(2014苏锡常二模节选) 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1) CO可用于炼铁,已知:Fe2O3(s)+3C(s)

2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1,
C(s)+CO2(g)

2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2) 分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3) CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)
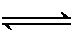
CH3OH(g)+H2O(g)。
测得CH3OH的物质的量随时间的变化见图1。
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ (填“>”、“=”或“<”)KⅡ。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4) 利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在015h内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
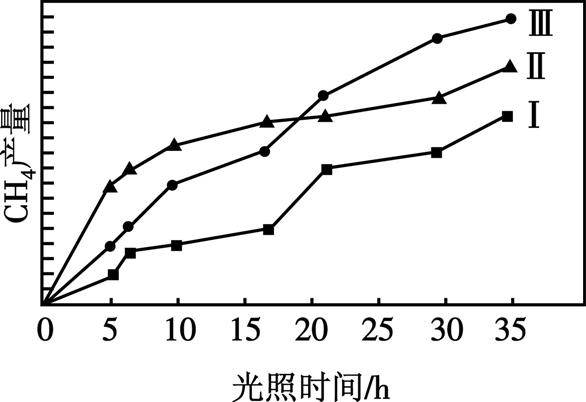
图2
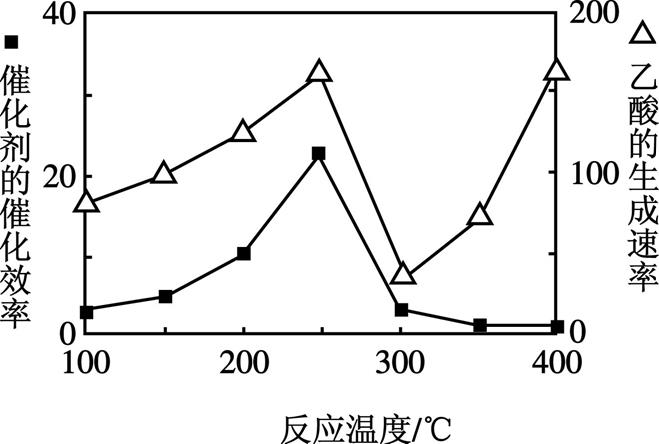
图3
(5) 以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。乙酸的生成速率主要取决于温度影响的范围是 。
[答案]
(1) Fe2O3(s)+3CO(g)

2Fe(s)+3CO2(g) ΔH=-28.5kJ·mol-1
(2) CO+4OH--2e-

CO32-+2H2O (3) ①> ②0.4Ⅲ>Ⅰ (5) 300~400℃
[解析] (1) 根据盖斯定律,反应Ⅰ-反应Ⅱ×3,ΔH=ΔH1-3ΔH2=-28.5 kJ·mol-1。(2) 负极发生氧化反应,碱性条件下,CO的氧化产物以CO32-形式呈现。
(3) ①从曲线可知Ⅱ的温度高,升高温度,平衡逆向移动,结合化学平衡常数的表达式可知KⅠ>KⅡ; ②三段式计算:
CO2(g) +3H2(g)

CH3OH(g) +H2O(g)
起始/mol: 1 3 0 0
转化/mol: x 3x x x
平衡/mol: 1-x 3-3x x x
1-x+3-3x+x+x=4×0.8,则x=0.4,即甲容器中平衡后,甲醇的物质的量为0.4 mol,要使平衡后乙容器与甲容器中相同组分的体积分数相等,起始时维持化学反应向逆反应方向进行,所以c的最大值是1,且>0.4,则c的取值范围为0.4
(5) 300~400 ℃时,乙酸的生成速率逐渐增大;
3. (2014镇江一模节选)污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染、水污染、土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+O2(g)

H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+O2(g)

CO(g) ΔH2=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填字母)。
a. Ca(OH)2 b. CaCl2 c. Na2CO3
d. NaHSO3
(2) 为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:
(NH4)2CO3(aq)+H2O(l)+CO2(g)

2NH4HCO3(aq) ΔH3。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如右图,则:
①ΔH3 (填“>”、“=”或“<”)0。
②在T4-T5这个温度区间,容器内CO2气体浓度变化趋势的原因是 。
(3) (2014泰州一模节选) H2S是一种无色、有毒且有恶臭味的气体。煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生。有研究组设计了一种硫化氢-空气燃料电池,总反应为2H2S+O2

2S↓+2H2O,简易结构如右图所示。
①硫化氢应通入到电极 (填“a”或“b”)。
②b极发生的电极反应为 。
[答案]
3.(1) ①C(s)+H2O(g)

CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 K=c(CO) c(H2)/c(H2O) ②ac
(2) ①<②T4-T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解)
(3) ①b ②H2S+O2-—2e-

S↓+H2O
[解析] (1) ①将第二个热化学方程式减去第一个热化学方程式即可得到目标热化学方程式:C(s)+H2O(g)

CO(g)+H2(g) ΔH=+131.3kJ·mol-1;②SO2溶于水后得到的亚硫酸(H2SO3)是一种中强酸,酸性强于碳酸,故可以用碱Ca(OH)2和盐Na2CO3来洗涤烟气。(2) 由图像可看出,在温度小于T3时,反应未达到平衡,CO2浓度在持续减小,当温度高于T3后,随着温度的升高,CO2的浓度增大,说明升高温度后捕碳反应向逆反应方向移动,故该反应的正反应为放热反应。(3) 根据图中电子的流向(电子从b电极流出)可知,电极b上失电子,结合反应的化学方程式可知,H2S在反应中失电子,故硫化氢应通入到电极b上;由于导电的离子是O2-,故在b电极上H2S失电子生成单质硫的同时结合O2-生成水,电极反应式为H2S-2e-+O2-

S↓+H2O。
4.(2014苏北四市期末调研测试节选)氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)已知H2S高温热分解制H2的反应为:
H2S(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。
请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(3)用惰性电极电解煤浆液的方法制H2的反应为:
C(s)+2H2O(l)=CO2(g)+2H2(g)
现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为
。
[答案](1)N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-179.38 kJ·mol-1
(2)0.4c/t mol·L-1·min-1 温度升高,反应速率加快,达到平衡所需的时间缩短
(3)C+2H2O-4e-=CO2↑+4H+(2分)
[解析](1)根据盖斯定律,三个反应直接相加即可得到目标反应。
(2)由H2S(g)
H2(g)+1/2S2(g)知,△c(H2)=c×40% mol/L ,
v(H2)=△c(H2)/t=0.4c/t mol·L-1
·min-1
随温度的升高,曲线b向曲线a逼近,因为a为H2S的平衡转化率与温度关系曲线,说明应该考虑温度升高,反应速率加快,达到平衡所需的时间缩短,因而向曲线a逼近。
(3)A极是阳极,失电子,发生氧化反应,根据总反应可知,C转化为CO2,失去4个e-,O由H2O提供,同时产生H+。
[问题思考]
| 1. 热化学方程式书写和反应热计算防错机制有哪些? |
| 2.如何利用化学平衡常数判断反应进行的方向? |
答案提示:1.首先热化学方程式中物质聚集状态很重要,必须看清和标明。其次利用盖斯定律进行计算和书写新的热化学方程式,必须注意:一是化学计量数关系,决定乘和除的倍数;二是反应物的方位,决定加和减的关系。方程式和反应热同步计算。
2.当Q=K时,化学反应处于平衡状态;
当Q
当 Q>K时,反应逆向进行。

 奥特曼闯关游戏推荐合集
奥特曼闯关游戏推荐合集 速通大赛2025:善款255万美元创新纪录
速通大赛2025:善款255万美元创新纪录 巫师3团队与其他工作室合作设计新任务
巫师3团队与其他工作室合作设计新任务 心态崩了看片这么多年女主角是谁【图片来源】
心态崩了看片这么多年女主角是谁【图片来源】 赵露思球操高清图片【附视频】
赵露思球操高清图片【附视频】 Zlata柔术cosplay玛丽莲梦露
Zlata柔术cosplay玛丽莲梦露 Rhino
Rhino LR
LR After Effects
After Effects pr
pr Maya
Maya 3DS MAX
3DS MAX Bridge
Bridge Illustrator
Illustrator Photoshop
Photoshop audition
audition